由于血脑屏障(BBB)的存在,系统性给药难以被递送到大脑中的神经元,大多数生物制剂(例如重组蛋白、治疗性抗体、核酸)都会受到这一限制。
mRNA作为一种新的药物类型,已被用于疾病的预防和治疗。为了在体内发挥作用,mRNA需要安全、有效和稳定的递送系统,以保护mRNA免受降解,并允许其被细胞摄取以及在细胞内释放。各种病毒和非病毒载体已经开发用于递送mRNA,包括逆转录病毒载体、脂质纳米颗粒、聚合物载体、蛋白衍生物,以及细胞外囊泡。然而,然而,在大脑中实现有效和靶向的体内递送仍然是基于RNA疗法的挑战。
2024年2月19日,康奈尔大学江绍毅教授团队联合麻省理工学院 Robert Langer 教授,在 Nature 子刊 Nature Biomedical Engineering 上发表了题为:Extracellular vesicles incorporating retrovirus-like capsids for the enhanced packaging and systemic delivery of mRNA into neurons 的研究论文。
该研究通过对白细胞进行工程改造,使其产生含有能够包装mRNA的逆转录病毒样衣壳的细胞外囊泡(EV),可以增强将mRNA包装到白细胞来源的EV和神经元EV的内吞作用。还使用编码衣壳形成活性调节的细胞骨架相关蛋白(Arc)和衣壳稳定性Arc 5'-非编码区RNA元件的DNA或RNA转染永生化和原代骨髓来源的白细胞。这些工程逆转录转座子Arc EV(eraEV)从供体白细胞中继承了内皮黏附分子,将内源性包膜蛋白招募到其表面,能够穿过血脑屏障,并进入神经炎症部位的神经元。这些eraEV由自身来源的供体白细胞产生,具有免疫惰性,并在低度慢性神经炎症小鼠模型中增强了神经元对其递送的mRNA的摄取。

在脑部炎症刺激下,血脑屏障(BBB)被破坏,脑微血管内皮细(BMEC)表现出更高的通透性,白细胞粘附分子的表达增加。这些允许循环白细胞来源的细胞外囊泡(EV)进入大脑,使它们成为靶向神经元的药物载体的理想候选者。
在各种神经系统疾病中,包括年龄相关慢性炎症、神经退行性疾病以及其他更严重的病理变化(例如全身炎症和中风),血脑屏障对白细胞来源的细胞外囊泡(EV)变得更加通透。然而,基于EV的治疗方法在这些疾病的临床转化中受到了低货物封装效率和缺乏对从供体细胞中装载到EV的分子的控制的阻碍。EV中装载的货物可能包括蛋白质、DNA、RNA、脂质、营养物质和代谢废物等,而不想要的组分难以从EV中被排除,这不仅会损害了其装载能力,还会将潜在有害组分递送到靶细胞。
目前,使用EV来装在长mRNA仍然存在挑战,在自然条件下高效和选择性地将mRNA载入EV的能力对于设计EV作为治疗药物载体至关重要。
为了提高EV的RNA装载能力,研究团队在EV腔内加入了人类大脑中天然存在的逆转录病毒样蛋白质衣壳,这些病毒衣壳在促进中枢神经系统(CNS)内的细胞间通讯中发挥作用。
长末端重复序列(LTR)逆转录转座子和逆转录病毒的转座基因组元件广泛分布于真核生物领域,它们具有相同的起源。
LTR逆转录转座子和逆转录病毒衣壳蛋白(Gag)同源物Arc(活性调节细胞骨架相关蛋白)可能与感染性RNA逆转录病毒具有类似的进化和作用。PEG10是另一种Gag同源物,最近被张锋实验室开发成为一种用于mRNA递送的病毒样颗粒。
Arc蛋白可自组装成病毒样衣壳来封装mRNA,尽管Arc EV作为载体具有巨大潜力,但其在药物传递方面的研究还不够。在未添加其非翻译区(UTR)的情况下,Arc和Gag被报道在mRNA转导方面效率低,对特定货物的特异性较低。
在这项研究中,研究团队将Arc 5' UTR(A5U)添加到递送货物结构中稳定了衣壳,增加了货物装载能力。因此,将Arc蛋白质衣壳与A5U RNA基序稳定剂一起引入EV腔内,以实现mRNA的高效封装和递送。
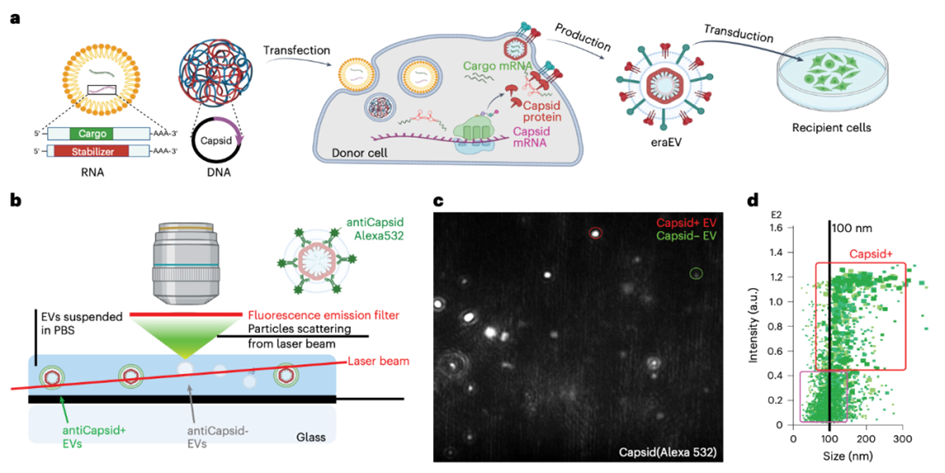
除了具有更强的货物装载能力外,该递送系统还提供了几个额外的优势:
首先,从自体白细胞中产生的工程逆转录转座子Arc EV(eraEV)在免疫上是惰性的,并通过供体白细胞的膜分子帮助在炎症微环境中富集,并通过血脑屏障迁移。
其次,Arc组件在自组装过程中招募包膜蛋白,并随后根据其介导神经元间分子交换的天然功能,促进受体神经元的EV细胞摄取。
第三,病毒样衣壳使eraEV比其他工程RNA载体EV更稳定,保护递送的RNA免受RNA酶的降解,直至其进入细胞内并释放。
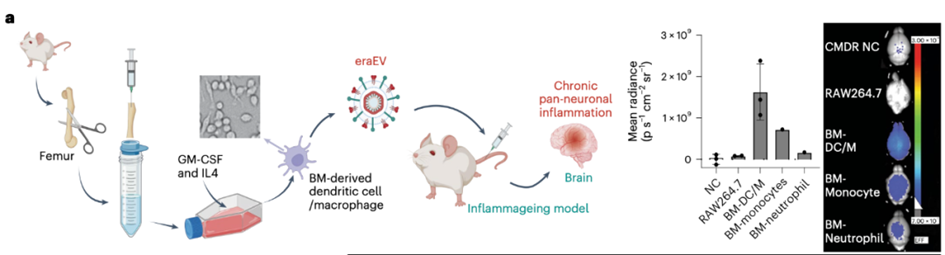
除了利用这些独特的病毒样特性外,eraEV还具有良好的安全性。它们作为瞬时药物载体,没有复制、感染或将遗传信息插入受体细胞基因组的能力。重要的是,eraEV可以从大多数供体细胞中产生,并基于不同细胞类型的Es的天然靶向能力,用于广泛的生物医学应用。
总的来说,该研究展示了一种内源性病毒样递送系统,能够在体内装载和递送mRNA,特别是通过系统性给药靶向神经元。
论文链接:
https://www.nature.com/articles/s41551-023-01150-x













